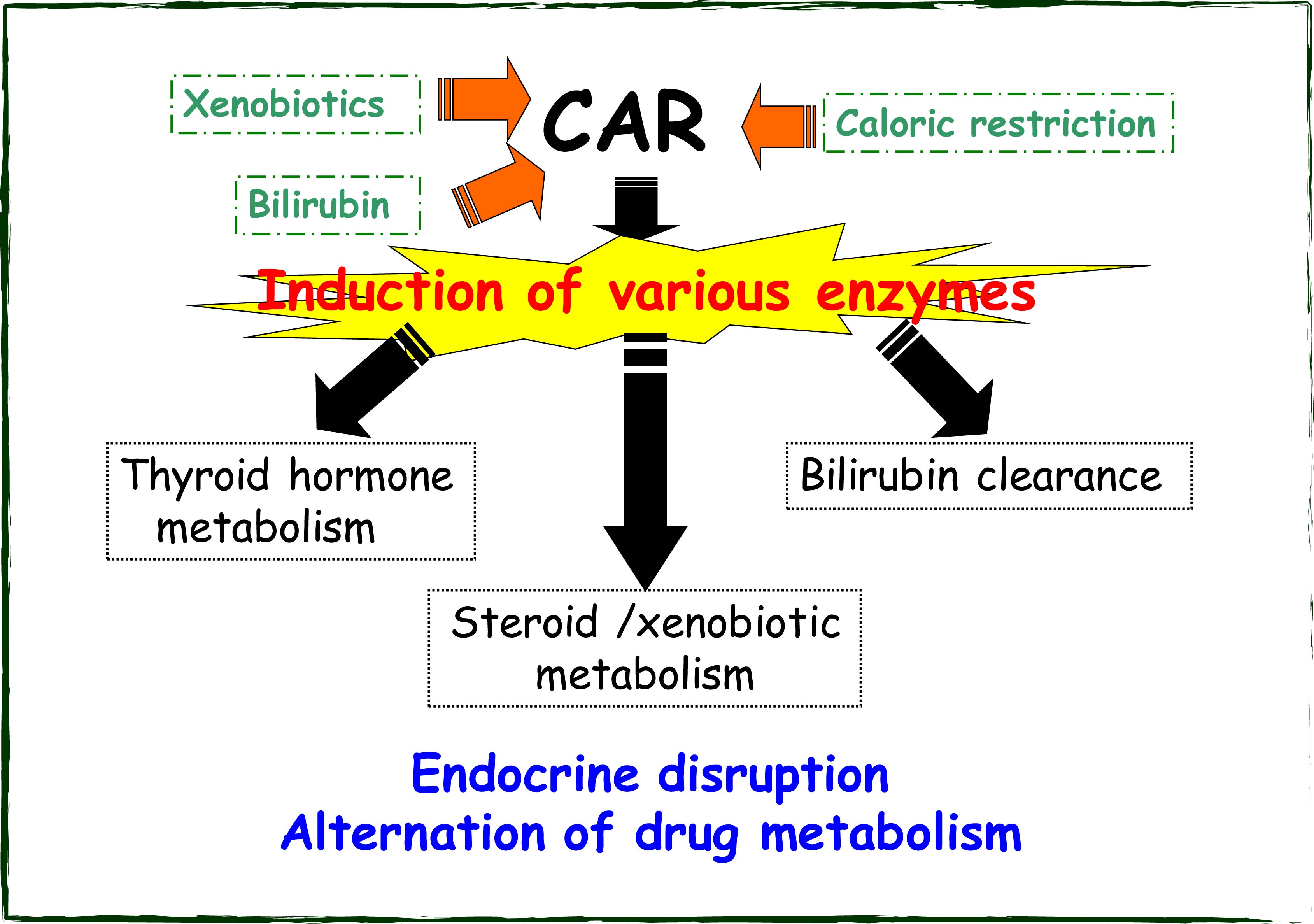

生体防御機構には、感染性微生物対しては免疫応答があるように、医薬品や環境汚染物質など有害な低分子物質に対しては代謝酵素の誘導がみられます。異物を感知し、標的遺伝子、例えば代謝酵素遺伝子の転写活性化を誘導するのが細胞内レセプターの役割といえます。代表的なものとしては主としてCYP1Aを誘導するAhR、CYP2Bを誘導するCAR、CYP3Aを誘導するPXR、CYP4Aを誘導するPPARが知られています。私たちの研究室ではCARを中心に異物認識から酵素誘導までの情報の流れについて解析を行っております。核内レセプターCARは異物によって活性化するとさまざまな代謝酵素を誘導します。CARによる代謝酵素の誘導によって、異物・薬物・ステロイド・甲状腺ホルモンの代謝の促進、ビリルビンクリアランスの増加などが変化することが知られています。それによって内分泌の撹乱や薬物代謝の変化が引き起こされると考えられています。
CARは非刺激下においては細胞質に局在しています。そこに異物や薬物による刺激によって活性化すると細胞質から核内へ移行しRXRと二量体を形成し標的遺伝子プロモーター上にある応答配列を認識し結合します。プロモーター上に結合したCAR/RXRはコアクチベーターをリクルートすることによって転写を促進し、標的遺伝子(CYP2B,
3Aなど)を誘導します。CARの場合一般的な核内レセプターとは異なり活性化にリガンドの結合は必要ではなく、細胞質から核への局在の変化によって活性が調節されています。
1) Kanno Y, Aoki S, Nakahama T, Inouye Y. (2003) Role of the Defective Splicing of mRNA in the Lack of Pulmonary Expression
of Constitutively Active Receptor in Rat J Health Sci. 49:541-546
2) Kanno Y, Moriyama T, Ichikawa H, Mizuno M, Nakahama T, Inouye Y. (2004) Transcriptional Determination of Sexually Dimorphic Expression of Nuclear
Receptor Constitutively Active Receptor (CAR) in Wistar Rats J Health Sci. 50:384-8
3) Kanno Y, Otsuka S, Hiromasa T, Nakahama T, Inouye Y. (2004) Diurnal
difference in CAR mRNA expression. Nucl Recept. 28;2:6.
4) Kanno Y, Aoki S, Mochizuki M, Mori E, Nakahama T, Inouye Y. (2005) Expression
of constitutive androstane receptor splice variants in rat liver and lung
and their functional properties. Biol Pharm Bull. 28:2058-62.
5) Kanno Y, Suzuki M,
Nakahama T, Inouye Y. (2005) Characterization
of nuclear localization signals and cytoplasmic retention region in the nuclear
receptor CAR. Biochim Biophys Acta. Mol Cell Res. 1745:215-22.
6) Kanno Y, Suzuki M, Miyazaki Y, Matsuzaki M, Nakahama T, Kurose K, Sawada J, Inouye Y. (2007) Difference in nucleocytoplasmic
shuttlingsequences of rat and human constitutive active/androstane receptor. Biochim Biophys Acta. Mol Cell Res. 1773:934-44.
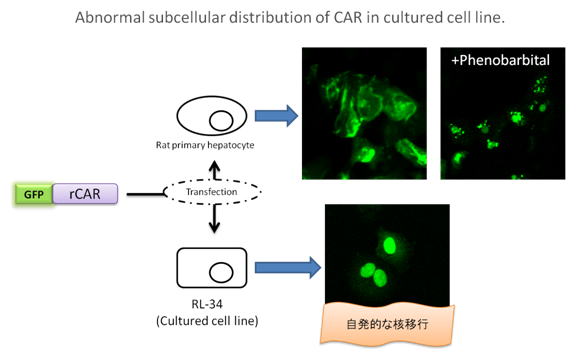
CARの活性化は肝や初代培養肝細胞などでは観察することができますが、継代培養細胞ではCARがほとんど発現しておらずCARの活性化は観察することができません。さらに培養細胞にCARを過発現させるとアクチベーターの非存在下においても恒常的に活性化してしまうためアクチベーターによる活性化を観察することはできません。その原因としてCARは肝や初代培養肝細胞では細胞質に局在しており、アクチベーターの処理によって核へ移行します(上図上)。しかし、継代培養細胞では自発的に核へ移行してしまいます(上図下)。この自発的核移行により培養細胞ではCARは発現のみで恒常的活性化してしまうと考えられています。 そのため現在は動物実験やコラーゲンゲル培養した初代培養肝細胞系が用いられていますが,実験操作の煩雑性や倫理的観点から培養細胞を用いた実験系が求められています。本研究室では培養細胞におけるCARの細胞内局在性のメカニズムを解明し、培養細胞を用いたCARの活性化評価系を構築することを目的としています。それによって薬物の相互作用の予測や薬物代謝酵素誘導メカニズムの解明に大きく貢献できるものと考えています。
また、CARの局在の変化はほとんどの不死化した継代培養細胞で観察できることから局在の違いのメカニズムを明らかにすることによって、継代培養細胞と正常細胞の違いも明らかになってくると考えています。